СЕРА
Размещение электронов по уровням и подуровням
| 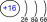
| 1s22p22p63s23p4 |
| Размещение электронов по орбиталям
(последний слой) | Степень
окисления | Валентность |
| 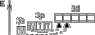
| +2 | II |
| 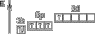
| +4 | IV |
| 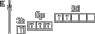
| +6 | VI |
Получение
1. 2H2S + O2® 2S + 2H2O
2. 2H2S + SO2® 3S + 2H2O
Химические свойства
Окислительные свойства серы (S0+ 2ē ®S-2)
3. Сера реагирует со щелочными металлами без нагревания
2Na + S ® Na2S
4. c остальными металлами (кроме Au, Pt) - при повышенной t°
2Al + 3S –t°® Al2S3
Zn + S –t°® ZnS
5. С некоторыми неметаллами сера образует бинарные соединения
H2 + S ® H2S
2P + 3S ® P2S3
C + 2S ® CS2
Восстановительные свойства сера проявляет в реакциях с сильными окислителями: (S - 2ē ®S+2; S - 4ē ®S+4; S - 6ē ®S+6)
6. S + O2 –t°® S+4O2
7. 2S + 3O2 –t°;pt® 2S+6O3
8. c галогенами (кроме йода):
S + Cl2® S+2Cl2
9. c кислотами - окислителями:
S + 2H2SO4(конц)® 3S+4O2 + 2H2O
S + 6HNO3(конц)® H2S+6O4 + 6NO2 + 2H2O
10. 3S0 + 6KOH ® K2S+4O3 + 2K2S-2 + 3H2O
11. сера растворяется в концентрированном растворе сульфита натрия:
S0 + Na2S+4O3® Na2S2O3тиосульфат натрия
СЕРОВОДОРОД
Получение
12. H2 + S ¬t°® H2S
13. FeS + 2HCl ® FeCl2 + H2S
14. Химические свойства
15. Раствор H2S в воде – слабая двухосновная кислота:
H2S « H+ + HS-« 2H+ + S2-
16. Взаимодействует с основаниями:
H2S + 2NaOH ® Na2S + 2H2O
17. H2S проявляет очень сильные восстановительные свойства:
H2S-2 + Br2® S0 + 2HBr
H2S-2 + 2FeCl3® 2FeCl2 + S0 + 2HCl
H2S-2 + 4Cl2 + 4H2O ® H2S+6O4 + 8HCl
3H2S-2 + 8HNO3(конц) ® 3H2S+6O4 + 8NO + 4H2O
H2S-2 + H2S+6O4(конц)® S0 + S+4O2 + 2H2O
(при нагревании реакция идет по - иному:
H2S-2 + 3H2S+6O4(конц) –t°® 4S+4O2 + 4H2O)
18. Сероводород окисляется:
при недостатке O2
2H2S-2 + O2® 2S0 + 2H2O
при избытке O2
2H2S-2 + 3O2® 2S+4O2 + 2H2O
19. Серебро при контакте с сероводородом чернеет:
4Ag + 2H2S + O2® 2Ag2S + 2H2O
20. Качественная реакция на сероводород и растворимые сульфиды - образование темно-коричневого (почти черного) осадка PbS:
H2S + Pb(NO3)2® PbS¯ + 2HNO3
Na2S + Pb(NO3)2® PbS¯ + 2NaNO3
Pb2+ + S2- ® PbS¯
PbS + 4H2O2® PbSO4(белый) + 4H2O
Сульфиды
Получение
21. Многие сульфиды получают нагреванием металла с серой:
Hg + S ® HgS
22. Растворимые сульфиды получают действием сероводорода на щелочи:
H2S + 2KOH ® K2S + 2H2O
23. Нерастворимые сульфиды получают обменными реакциями:
CdCl2 + Na2S ® 2NaCl + CdS¯
Pb(NO3)2 + Na2S ® 2NaNO3 + PbS¯
ZnSO4 + Na2S ® Na2SO4 + ZnS¯
MnSO4 + Na2S ® Na2SO4 + MnS¯
2SbCl3 + 3Na2S ® 6NaCl + Sb2S3¯
SnCl2 + Na2S ® 2NaCl + SnS¯
Химические свойства
24. Растворимые сульфиды сильно гидролизованы, вследствие чего их водные растворы имеют щелочную реакцию:
K2S + H2O « KHS + KOH
S2- + H2O « HS- + OH-
25. Сульфиды металлов, стоящих в ряду напряжений левее железа (включительно), растворимы в сильных кислотах:
ZnS + H2SO4® ZnSO4 + H2S
HgS + H2SO4 –®
26. Нерастворимые сульфиды можно перевести в растворимое состояние действием концентрированной HNO3:
FeS2 + 8HNO3® Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
27. Водорастворимые сульфиды растворяют серу с образованием полисульфидов:
Na2S + nS ® Na2Sn+1 (1 £ n £ 5)
28. Полисульфиды при окислении превращаются в тиосульфаты, например:
2Na2S2 + 3O2® 2Na2S2O3
Оксид серы IV - SO2
(сернистый ангидрид; сернистый газ)
Физические свойства
Бесцветный газ с резким запахом; хорошо растворим в воде (в 1VH2O растворяется 40VSO2 при н.у.); t°пл. = -75,5°C; t°кип. = -10°С.
Обесцвечивает многие красители, убивает микроорганизмы.
Получение
29. При сжигании серы в кислороде:
S + O2® SO2
30. Окислением сульфидов:
4FeS2 + 11O2® 2Fe2O3 + 8SO2
31. Обработкой солей сернистой кислоты минеральными кислотами:
Na2SO3 + 2HCl ® 2NaCl + SO2 + H2O
32. При окислении металлов концентрированной серной кислотой:
Cu + 2H2SO4(конц)® CuSO4 + SO2 + 2H2O
Химические свойства
33. Сернистый ангидрид - кислотный оксид. При растворении в воде образуется слабая и неустойчивая сернистая кислота H2SO3 (существует только в водном растворе)
SO2 + H2O « H2SO3 ¬K1® H+ + HSO3- ¬K2® 2H+ + SO32-
K1 = ([H+] • [HSO3-]) / [H2SO3] = 1,6 • 10-2
K2 = ([H+] • [SO32-]) / [HSO3-] = 1,3 • 10-7
34. H2SO3 образует два ряда солей - средние (сульфиты) и кислые (бисульфиты, гидросульфиты).
Ba(OH)2 + SO2® BaSO3¯(сульфит бария) + H2O
Ba(OH)2 + 2SO2® Ba(HSO3)2(гидросульфит бария)
35. Реакции окисления (S+4 – 2ē ® S+6)
SO2 + Br2 + 2H2O ® H2SO4 + 2HBr
5SO2 + 2KMnO4 + 2H2O ® K2SO4 + 2MnSO4 + 2H2SO4
36. Водные растворы сульфитов щелочных металлов окисляются на воздухе:
2Na2SO3 + O2® 2Na2SO4; 2SO32- + O2® 2SO42-
37. Реакции восстановления (S+4 + 4ē ® S0)
SO2 + С –t°® S + СO2
SO2 + 2H2S ® 3S + 2H2O
Оксид серы VI - SO3
(серный ангидрид)
Получение
38. 2SO2 + O2 ¬кат;450°C® 2SO3
39. Fe2(SO4)3 –t°® Fe2O3 + 3SO3
Химические свойства
Серный ангидрид - кислотный оксид. При растворении в воде дает сильную двухосновную серную кислоту:
SO3 + H2O®H2SO4«H+ + HSO4-« 2H+ + SO42-
H2SO4 образует два ряда солей - средние (сульфаты) и кислые (гидросульфаты):
2NaOH + SO3®Na2SO4 + H2O
NaOH + SO3®NaHSO4
СЕРНАЯ КИСЛОТА
40. разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + H2+1SO4(разб)® Zn+2SO4 + H2O
41. концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt)
2Ag0 + 2H2+6SO4® Ag2+1SO4 + S+4O2 + 2H2O
8Na0 + 5H2+6SO4® 4Na2+1SO4 + H2S-2 + 4H2O
42. С0 + 2H2S+6O4(конц)® C+4O2 + 2S+4O2 + 2H2O
43. S0 + 2H2S+6O4(конц)® 3S+4O2 + 2H2O
44. 2P0 + 5H2S+6O4(конц) ® 5S+4O2 + 2H3P+5O4 + 2H2O
45. с основными оксидами:
CuO + H2SO4® CuSO4 + H2O
CuO + 2H+ ® Cu2+ + H2O
46. с гидроксидами:
H2SO4 + 2NaOH ® Na2SO4 + 2H2O
H+ + OH- ® H2O
H2SO4 + Cu(OH)2® CuSO4 + 2H2O
2H+ + Cu(OH)2® Cu2+ + 2H2O
47. обменные реакции с солями:
BaCl2 + H2SO4® BaSO4¯ + 2HCl
Ba2+ + SO42-® BaSO4¯
АЗОТ
Получение
48. Лабораторный способ. Разложение нитрита аммония:
NH4NO2 –t°® N2 + 2H2O
Химические свойства
Восстановитель N20® 2N+2
49. Высокая температура (электрическая дуга, 3000°С), во время грозы)
N20 + O2« 2N+2O
Окислитель N20® 2N-3
50. c водородом (500°С, kat, p)
N20 + 3H2« 2N-3HЗ
51. с активными металлами (с щелочными и щел.зем. металлами)
6Li + N20® 2LiЗN-3
3Mg + N20 –t°® MgЗN2-3
АММИАК NH3
Получение
52. Промышленный способ (p=1000 атм; t°= 500°C; kat = Fe + алюмосиликаты; принцип циркуляции).
N2 + 3H2® 2NH3
53. Лабораторный способ. Нагревание солей аммония со щелочами.
2NH4Cl + Ca(OH)2 –t°® CaCl2 + 2NH3 + 2Н2O
(NH4)2SO4 + 2KOH –t°® K2SO4 + 2NH3 + 2Н2O
Химические свойства
54. NH3 + Н2O « NH4OH « NH4+ + OH-
55. Аммиак реагирует с кислотами с образованием солей аммония.
NH3 + HCl ® NH4Cl
2NH3 + H2SO4® (NH4)2SO4
NH3 + H2O + CO2® NH4HCO3
56. Разложение при нагревании
2N-3H3 ¬t°® N20 + 3H2
57. Горение в кислороде
a) без катализатора
4N-3H3 + 3O2® 2N20 + 6Н2O
b) каталитическое окисление ( kat = Pt )
4N-3H3 + 5O2® 4N+2O + 6Н2O
58. Восстановление оксидов некоторых металлов
3Cu+2O + 2N-3H3® 3Cu0 + N20 + 3Н2O
СОЛИ АММОНИЯ
Получение
59. Аммиак (или гидроксид аммония) + кислота.
NH3 + HNO3® NH4NO3(нитрат аммония)
2NH4OH + H2SO4® (NH4)2SO4(cульфат аммония) + 2Н2O
Химические свойства
60. Сильные электролиты (диссоциируют в водных растворах)
NH4Cl « NH4+ + Cl-
61. Разложение при нагревании.
a) если кислота летучая
NH4Cl ¬t°® NH3 + HCl
NH4HCO3® NH3 + Н2O + CO2
b) если анион проявляет окислительные свойства
NH4NO3 –t°® N2O + 2Н2O
(NH4)2Cr2O7 –t°® N2 + Cr2O3 + 4Н2O
62. С кислотами и солями (реакция обмена)
(NH4)2CO3 + 2НCl ® 2NH4Cl + Н2O + CO2
2NH4++ CO32- + 2H+ + 2Cl-® 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+® Н2O + CO2
(NH4)2SO4 + Ba(NO3)2® BaSO4¯ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3-® BaSO4¯ + 2NH4+ + 2NO3-
Ba2+ + SO42-® BaSO4¯
63. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O « NH4OH + HCl
NH4+ + Н2O « NH4OH + H+
64. При нагревании со щелочами выделяют аммиак (качественная реакция на NH4+)
NH4Cl + NaOH –t°® NaCl + NH3 + Н2O
Оксид азота (I) N2+1O
закись азота, "веселящий газ"
Получение
65. NH4NO3 –t°® N2O + 2Н2O
Химические свойства
66. Разлагается при 700°C с выделением кислорода:
2N2+1O –t°® 2N20 + O20
67. поэтому он поддерживает горение и является окислителем
С водородом:
N2+1O + H2® N20 + Н2O
Оксид азота (II) N+2
O окись азота
Получение
68. Каталитическое окисление аммиака (промышленный способ)
4NH3 +5O2® 4NO + 6H2O
69. 3Cu + 8HNO3(разб.)® 3Cu(NO3)2 + 2NO + 4H2O
70. N2 + O2 ® 2NO (в природе, во время грозы)
Химические свойства
71. Легко окисляется кислородом и галогенами
2NO + O2® 2NO2
2NO + Cl2® 2NOCl(хлористый нитрозил)
72. Окислитель
2N+2O + 2S+4O2® 2S+6O3 + N20
Оксид азота (III) N2+3O3
азотный ангидрид
Получение
73. NO2 + NO « N2O3
Химические свойства
74. Все свойства кислотных оксидов.
N2O3 + 2NaOH ® 2NaNO2(нитрит натрия) + H2O
Оксидазота (IV) N+4O2
двуокисьазота, диоксидазота
Получение
75. 2NO + O2® 2NO2
76. Cu + 4HNO3(конц.)® Cu(NO3)2 + 2NO2 + 2H2O
77.
Химическиесвойства
78. Кислотный оксид
с водой
2NO2 + H2O ® HNO3 + HNO2
4NO2 + 2H2O + O2® 4HNO3
со щелочами
2NO2 + 2NaOH ® NaNO2 + NaNO3 + H2O
79. Окислитель
N+4O2 + S+4O2® S+6O3 + N+2O
80. Димеризация
2NO2(бурый газ)« N2O4(бесцветная жидкость)
Оксид азота (V) N2+5O5
азотный ангидрид
Получение
81. 2NO2 + O3® N2O5 + O2
82. 2HNO3 +P2O5® 2HPO3 + N2O5
Химические свойства
83. Кислотный оксид
N2O5 + H2O ® 2HNO3
84. Легко разлагается (при нагревании - со взрывом):
2N2O5® 4NO2 + O2
АЗОТИСТАЯ КИСЛОТА NO2
Получение
85. AgNO2 + HCl ® HNO2 + AgCl¯
Химические свойства
86. Слабая кислота; ее соли (нитриты) – устойчивы:
HNO2 + NaOH ® NaNO2 + H2O
87. Разлагается при нагревании:
3HNO2® HNO3 + 2NO + H2O
88. Слабый окислитель (окислительные свойства проявляет только в реакциях с сильными восстановителями)
2KNO2 + 2KI + 2H2SO4® 2K2SO4 + I2 + 2NO + 2H2O
2I- - 2ē ® I20 1
NO2-+ 2H+ + 1ē ® NO + H2O 2
2I- + 2NO2- + 4H+ ® I20 + 2NO + 2H2O
89. Сильный восстановитель:
HNO2 + Cl2 + H2O ® HNO3 + 2HCl
АЗОТНАЯ КИСЛОТА HNO3
Получение
90. Лабораторный способ
KNO3 + H2SO4(конц) –t°® KHSO4 + HNO3
91. Промышленный способ. Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 –500°,Pt® 4NO + 6H2O
b) Окисление кислородом воздуха NO до NO2
2NO + O2® 2NO2
c) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O « 4HNO3
Химические свойства
92. Диссоциирует в водном растворе практически нацело:
HNO3« H+ + NO3-
93. с основными оксидами
CuO + 2HNO3® Cu(NO3)2 + H2O
CuO + 2H+ + 2NO3-® Cu2+ + 2NO3- + H2O
или CuO + 2H+® Cu2+ + H2O
94. с основаниями
HNO3 + NaOH ® NaNO3 + H2O
H+ + NO3- + Na+ + OH-® Na+ + NO3- + H2O
или H+ + OH-® H2O
95. вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3® 2NaNO3 + H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32-® 2Na+ + 2NO3- + H2O + CO2
2H+ + СO32-® H2O + CO2
Специфические свойства азотной кислоты
96. Разлагается на свету и при нагревании
4HNO3 –t°,hn® 2H2O + 4NO2 + O2
97. При взаимодействии с металлами никогда не выделяется водород
металл + HNO3® соль азотной кислоты + вода + газ
98. Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц)® H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3® H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O ® 5NO + 3H3P+5O4
РАЗЛОЖЕНИЕ НИТРАТОВ
Реакции разложения нитратов при нагревании
99. Нитраты щелочных металлов разлагаются до нитритов:
2NaNO3 –t°® 2NaNO2 + O2
100. Нитраты менее активных металлов (от щелочноземельных до меди) разлагаются до оксидов:
2Mg(NO3)2 –t°® 2MgO + 4NO2 + O2
2Cu(NO3)2 –t°® 2CuO + 4NO2 + O2
101. Нитраты наименее активных металлов разлагаются до металлов:
102. Hg(NO3)2 –t°® Hg + 2NO2 + O2
2AgNO3 –t°® 2Ag + 2NO2 + O2
103. Нитрат аммония разлагаются до N2O
NH4NO3 –t°® N2O + 2H2O
ФОСФОР И ЕГО СОЕДИНЕНИЯ
Электронная конфигурация 1S22S22P63S23P3
Получение
104. Красный и черный фосфор получают из белого. Белый фосфор получают восстановлением фосфата кальция (сплавление в электрической печи):
Ca3(PO4)2 + 3SiO2 + 5C –t°® 3CaSiO3 + 5CO + 2P
Химические свойства.
105. Реакции с кислородом:
4P0 + 5O2 –t°® 2P2+5O5
(при недостатке кислорода:
P0 + 3O2 –t°® 2P2+3O3)
106. С галогенами и серой:
2P + 3Cl2® 2PCl3
2P + 5Cl2® 2PCl5
2P + 5S –t°® P2S5
(галогениды фосфора легко разлагаются водой, например:
PCl3 + 3H2O ® H3PO3 + 3HCl
PCl5 + 4H2O ® H3PO4 + 5HCl)
107. С азотной кислотой:
3P0 + 5HN+5O3 + 2H2O® 3H3P+5O4 + 5N+2O
108. С металлами образует фосфиды, в которых фосфор проявляет степень окисления - 3:
2P0 + 3Mg ® Mg3P2-3
(фосфид магния легко разлагается водой
Mg3P2 + 6H2O ® 3Mg(OH)2 + 2PH3(фосфин))
3Li + P ® Li3P-3
109. Со щелочью:
4P + 3NaOH + 3H2O ® PH3 + 3NaH2PO2
Фосфин PH3
Получение
110. Фосфиды щелочных и щелочноземельных металлов разлагаются водой и кислотами с образованием фосфина:
Ca3P2 + 6HCl® 3CaCl2 + 2PH3
Ca3P2-3 + 6H2O® 3Ca(OH)2+ 2P-3H3
Химические свойства.
111. Разлагается при нагревании:
2PH3 –t°® 2P + 3H2
112. Проявляет слабые основные свойства:
PH3 + HI ® [PH4]+I-
йодистый фосфоний менее устойчивый, чем соли аммония.
Фосфористый ангидрид
(оксид фосфора (III)) P2O3
Получение
113. Окисление фосфора при недостатке кислорода
4P + 3O2® 2P2O3
Химические свойства
114. Все свойства кислотных оксидов.
P2O3 + 3H2O® 2H3PO3
115. Сильный восстановитель
O2+ P2+3O3® P2+5O5
Фосфорный ангидрид
(оксид фосфора (V)) P2O5
Получение
116. 4P + 5O2 ® 2P2O5
Химические свойства
117. P2O5 + H2O ® 2HPO3(метафосфорная кислота)
P2O5 + 2H2O ® H4P2O7(пирофосфорная кислота)
P2O5 + 3H2O ® 2H3PO4(ортофосфорная кислота)
118. P2O5 + 3BaO ® Ba3(PO4)2
119. P2O5 + 6KOH ® 2K3PO4+ 3H2O
120. P2O5+ 2HNO3® 2HPO3 + N2O5
P2O5+ 2HClO4® 2HPO3+ Cl2O7
Метафосфорная кислота HPO3
Получение
121. P2O5+ H2O ® 2HPO3
Соли метафосфорной кислоты - метафосфаты (KPO3 – метафосфат калия)
Фосфористая кислота H3PO3
Получение
122. PCl3+ 3H2O ® H3PO3+ 3HCl
Химические свойства
123. Водный раствор H3PO3 - двухосновная кислота средней силы (соли – фосфиты):
H3PO3+ 2NaOH®Na2HPO3+ 2H2O
124. При нагревании происходит превращение в ортофосфорную кислоту и фосфин:
4H3PO3® 3H3PO4+ PH3
125. Восстановительные свойства:
H3PO3+ HgCl2+ H2O ® H3PO4+ Hg + 2HCl
Ортофосфорная кислота. H3PO4
126. Диссоциация:
H3PO4« 3H+ + PO4-3
H3PO4+ 3H2O « 3H3O+ + PO43-
H3PO4« H+ + H2PO4-
H2PO4-« H+ + HPO42-
HPO42-« H+ + PO43-
Получение
127. P2O5+ 3H2O ® 2H3PO4
128. Промышленный способ:
Ca3(PO4)2(твердый) + 3H2SO4(конц.) ® 2H3PO4+ 3CaSO4¯
129. 3P + 5HNO3+ 2H2O ® 3H3PO4+ 5NO
Химические свойства
130. При нагревании она превращается в пирофосфорную кислоту.
2H3PO4 –t°® H4P2O7 + H2O
131. Качественная реакция на обнаружение в растворе анионов PO43-
3Ag+ + PO43-® Ag3PO4¯(ярко-желтый осадок)
Фосфорные удобрения
132. Ca3(PO4)2 + 2H2SO4® Ca(H2PO4)2 + 2CaSO4
(Ca(H2PO4)2простой суперфосфат (обычно применяют в виде гранул Æ 2-4 мм))
Ca3(PO4)2 + 4H3PO4® 3Ca(H2PO4)2(двойной суперфосфат)
133. Нейтрализацией гашеной извести фосфорной кислотой получают преципитат:
H3PO4 + Ca(OH)2®CaHPO4• 2H2O
УГЛЕРОД
Химические свойства
Восстановительные свойства
134. с кислородом
C0 + O2 –t°® CO2 углекислый газ
при недостатке кислорода наблюдается неполное сгорание:
2C0 + O2 –t°® 2C+2O угарный газ
135. со фтором
С + 2F2® CF4
136. с водяным паром
C0 + H2O –1200°® С+2O + H2 водяной газ
137. с оксидами металлов
C0 + 2CuO –t°® 2Cu + C+4O2
138. с кислотами – окислителями:
C0 + 2H2SO4(конц.)® С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.)® С+4O2 + 4NO2 + 2H2O
Окислительные свойства
139. с некоторыми металлами образует карбиды
4Al + 3C0®Al4C3
Ca + 2C0®CaC2-4
140. с водородом
C0 + 2H2® CH4
Оксид углерода (II) CO
Получение
141. В промышленности (в газогенераторах):
C + O2®CO2
CO2 + C® 2CO
142. В лаборатории - термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH®H2O + CO
H2C2O4®CO + CO2 + H2O
Химические свойства
143. с кислородом
2C+2O + O2® 2C+4O2
144. с оксидами металлов
C+2O + CuO®Сu + C+4O2
145. с хлором (на свету)
CO + Cl2 –hn® COCl2(фосген)
146. реагирует с расплавами щелочей (под давлением)
CO + NaOH ® HCOONa(муравьинокислый натрий (формиат натрия))
147. с переходными металлами образует карбонилы
Ni + 4CO –t°® Ni(CO)4
Fe + 5CO –t°® Fe(CO)5
Оксид углерода (IV) СO2
Получение
148. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка:
CaCO3 –t°® CaO + CO2
149. Действием сильных кислот на карбонаты и гидрокарбонаты:
CaCO3 + 2HCl®CaCl2 + H2O + CO2
NaHCO3 + HCl®NaCl + H2O + CO2
Химические свойства
150. Кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Na2O + CO2®Na2CO3
2NaOH + CO2®Na2CO3 + H2O
NaOH + CO2® NaHCO3
151. При повышенной температуре может проявлять окислительные свойства
С+4O2 + 2Mg –t°® 2Mg+2O + C0
Качественная реакция
152. Помутнение известковой воды:
Ca(OH)2 + CO2 ® CaCO3¯(белый осадок) + H2O
153. Оно исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2® Сa(HCO3)2
Угольная кислота H2CO3
154. Кислота слабая, существует только в водном растворе:
CO2 + H2O « H2CO3
155. Двухосновная:
H2CO3« H+ + HCO3-
HCO3-« H+ + CO32-
156. Карбонаты и гидрокарбонаты могут превращаться друг в друга:
2NaHCO3 –t°® Na2CO3 + H2O + CO2
Na2CO3 + H2O + CO2 ® 2NaHCO3
157. Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида:
CuCO3 –t°® CuO + CO2
158. Качественная реакция - "вскипание" при действии сильной кислоты:
Na2CO3 + 2HCl® 2NaCl + H2O + CO2
CO32- + 2H+®H2O + CO2
КРЕМНИЙ
| 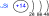
| 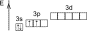
|
| 1s22s22p63s23p2 | |
| Возбуждённое состояние | 
|
Степени окисления: +4, -4.
Получение
159. 2С + Si+4O2 –t°® Si0 + 2CO
160. 2Mg + Si+4O2 –t°® 2MgO + Si0
Химические свойства
Типичный неметалл, инертен.
Как восстановитель:
161. С кислородом
Si0 + O2 –t°® Si+4O2
162. С фтором (без нагревания)
Si0 + 2F2® SiF4
163. С углеродом
Si0 + C –t°® Si+4C
(SiC - карборунд -твёрдый; используется для точки и шлифовки)
164. С водородом не взаимодействует. Силан (SiH4) получают разложением силицидов металлов кислотой:
Mg2Si + 2H2SO4®SiH4 + 2MgSO4
165. С кислотами не реагирует. Растворяется только в смеси азотной и плавиковой кислот:
3Si + 4HNO3 + 18HF® 3H2[SiF6] + 4NO + 8H2O
166. Со щелочами (при нагревании):
Si0 + 2NaOH + H2O®Na2Si+4O3+ 2H2
Как окислитель:
167. С металлами (образуются силициды):
Si0 + 2Mg –t°® Mg2Si-4
Силан SiH4
Получение
168. Mg2Si + 4HCl ® 2MgCl2 + SiH4
Химические свойства
169. SiH4 + 2O2® SiO2 + 2H2O
170. SiH4® Si + 2H2
Оксид кремния (IV) (SiO2)n
Химические свойства
171. С основными оксидами:
SiO2 + CaO ® CaSiO3
172. Со щелочами:
SiO2 + 2NaOH®Na2SiO3 + H2O
173. С водой не реагирует
174. С солями:
SiO2 + CaCO3® CaSiO3 + CO2
SiO2 + K2CO3® K2SiO3 + CO2
175. С плавиковой кислотой:
SiO2 + 4HF ® SiF4 + 2H2O
SiO2 + 6HF ® H2[SiF6](гексафторкремниевая кислота) + 2H2O
(реакции лежат в основе процесса травления стекла).
Кремниевыекислоты
x • SiO2 • y H2O
x = 1, y = 1 H2SiO3 - метакремниевая кислота
x = 1, y = 2 H4SiO4 - ортокремниевая кислота и т.д.
H2SiO3 - очень слабая (слабее угольной), непрочная, в воде малорастворима (образует коллоидный раствор), не имеет кислого вкуса.
Получение
176. Na2SiO3 + 2HCl ® 2NaCl + H2SiO3¯
177. При нагревании разлагается:
H2SiO3 –t°® H2O + SiO2
Хром и его соединения
| Атомный
номер | Название | Электронная
конфигурация | Степень
окисления |
| 24 | Хром Cr | [Ar] 3d54s1 | +1,+2,+3, +4,+5,+6 |
Получение
178. Алюминотермия:
Cr2O3 + 2Al ® Al2O3 + 2Cr
179. Электролизом водных растворов соединений хрома.
180. При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O2 –t°® 2Cr2O3
2Cr + 3Cl2 –t°® 2CrCl3
2Cr + N2 –t°® 2CrN
2Cr + 3S –t°® Cr2S3
181. В раскалённом состоянии реагирует с парами воды:
2Cr + 3H2O«Cr2O3 + 3H2
182. В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl®CrCl2 + H2
2Cr + 6HCl + O2® 2CrCl3 + 2H2O + H2
Гидроксид хрома (II)
183. Cr(OH)2 + 2HCl ® CrCl2 + 2H2O
184. Соединения хрома (II) - сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl® 2CrCl3 + H2
4Cr(OH)2 + O2 + 2H2O® 4Cr(OH)3
Оксид хрома (III) Cr2O3
185. 2Cr(OH)3 –t°® Cr2O3 + 3H2O
186. 4K2Cr2O7 –t°® 2Cr2O3 + 4K2CrO4 + 3O2
187. (NH4)2Cr2O7 –t°® Cr2O3 + N2+ 4H2O
188. Cr2O3 + 2NaOH ® 2NaCrO2 + H2O
189. Cr2O3 + Na2CO3® 2NaCrO2 + CO2
190. Cr2O3 + 6KHSO4® Cr2(SO4)3 + 3K2SO4 + 3H2O
191. При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
2Cr2O3 + 4KOH + KClO3® 2K2Cr2O7(дихромат калия) + KCl + 2H2O
Гидроксид хрома (III) Cr(OH)3
192. Cr2(SO4)3 + 6NaOH ® 2Cr(OH)3¯ + 3Na2SO4
193. Обладает амфотерными свойствами
2Cr(OH)3 + 3H2SO4® Cr2(SO4)3 + 6H2O
Cr(OH)3 + KOH ® K[Cr(OH)4]
(или, упрощая, Cr(OH)3 + KOH ® KCrO2(хромат калия) + 2H2O)
194. Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
Zn + 2Cr+3Cl3® 2Cr+2Cl2 + ZnCl2
2Cr+3Cl3 + 16NaOH + 3Br2® 6NaBr + 6NaCl + 8H2O + 2Na2Cr+6O4
Оксид хрома (VI) CrO3
195. Получают из хромата (или дихромата) калия и H2SO4(конц.).
K2CrO4 + H2SO4® CrO3 + K2SO4 + H2O
K2Cr2O7 + H2SO4® 2CrO3 + K2SO4 + H2O
196. CrO3 - кислотный оксид, со щелочами образует жёлтые хроматы
CrO3 + 2KOH ® K2CrO4 + H2O
197. В кислой среде хроматы превращаются в оранжевые дихроматы
2K2CrO4 + H2SO4®K2Cr2O7 + K2SO4 + H2O
198. В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH® 2K2CrO4 + H2O
199. Все соединения хрома (VI) - сильные окислители
4CrO3 + 3S® 3SO2 + 2Cr2O3
Марганец
| Атомный
номер | Название | Электронная
конфигурация | Атомный
радиус,
нм | Степень
окисления |
| 25 | Марганец Mn | [Ar] 3d54s2 | 0,131 | +2,+3,+4, +5,+6,+7 |
Получение
200. Алюмотермия:
3MnO2 + 4Al ® 2Al2O3 + 3Mn
Химические свойства
201. Реагирует с неметаллами, например, с серой:
Mn + S ® MnS
202. Растворяется в кислотах:
Mn + 2HCl®MnCl2 + H2
(При этом образуются соединения двухвалентного марганца).
203. MnO2 + H2® MnO + H2O
204. MnSO4 + 2NaOH ® Mn(OH)2¯ + Na2SO4
Mn2+ + 2OH-® Mn(OH)2
205. Легко растворимо в кислотах:
Mn(OH)2 + 2HCl ® MnCl2 + 2H2O
Mn(OH)2 + 2H+® Mn2+ + 2H2O
206. На воздухе Mn(OH)2 быстро темнеет в результате окисления:
2Mn(OH)2 + O2 + 2H2O® 2[MnO2 • 2H2O]
207. При действии сильных окислителей наблюдается переход Mn2+ в MnO4-:
2Mn(OH)2 + 5Br2 + 12NaOH –кат.CuSO4® 2NaMnO4 + 10NaBr + 8H2O
2Mn(NO3)2 + 5PbO2 + 6HNO3® 2HMnO4 + 5Pb(NO3)2 + 2H2O
2Mn(NO3)2 + 5NaBiO3 + 16HNO3® 2HMnO4 + 5NaNO2 + 5Bi(NO3)3 + 7H2O
Оксид марганца (IV)
208. Mn(NO3)2 –t°® MnO2 + 2NO2
209. Сильный окислитель:
MnO2 + 4HCl ® MnCl2 + Cl2 + 2H2O
210. При сплавлении с содой и селитрой образует манганат натрия тёмно - зелёного цвета:
MnO2 + Na2CO3 + NaNO3 –t°® Na2MnO4 + NaNO2 + CO2
211. Манганаты также могут быть получены при восстановлении перманганатов в щелочной среде:
Na2SO3 + 2KMn+7O4 + 2KOH®Na2SO4 + 2K2Mn+6O4 + H2O
212. Гидролиз манганатов протекает по схеме:
3K2MnO4 + 2H2O« 2KMnO4 + MnO2 + 4KOH
3MnO42- + 2H2O« 2MnO4- + MnO2 + 4OH-
Оксид марганца (VII)
213. 2KMnO4 + H2SO4® Mn2O7¯ + K2SO4 + H2O
214. При растворении в щелочах образует перманганаты:
Mn2O7 + 2KOH® 2KMnO4 + H2O
215. При нагревании разлагается с выделением кислорода:
2KMnO4 –t°® K2MnO4 + MnO2 + O2
ФТОР И ЕГО СОЕДИНЕНИЯ
Химические свойства
216. F2 - самый сильный окислитель из всех веществ:
2F2 + 2H2O® 4HF + O2
H2 + F2 ® 2HF (совзрывом)
Cl2 + F2 ® 2ClF
Фтористый водород
Получение
217. CaF2 + H2SO4(конц.)® CaSO4 + 2HF
Химические свойства
218. Раствор HF в воде - слабая кислота (плавиковая):
HF«H+ + F-
219. Плавиковая кислота растворяет стекло:
SiO2 + 4HF®SiF4+ 2H2O
SiF4 + 2HF®H2[SiF6] гексафторкремниевая кислота
ХЛОР И ЕГО СОЕДИНЕНИЯ
Получение
220. Окисление ионов Cl- сильными окислителями или электрическим током:
MnO2 + 4HCl®MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl® 2MnCl2 + 5Cl2 + 2KCl + 8H2O
K2Cr2O7 + 14HCl® 2CrCl3 + 2KCl + 3Cl2 + 7H2O
221. электролиз раствора NaCl (промышленный способ):
2NaCl + 2H2O®H2 + Cl2 + 2NaOH
Химические свойства
222. Реакции с металлами:
2Na + Cl2® 2NaCl
Ni + Cl2® NiCl2
2Fe + 3Cl2® 2FeCl3
223. Реакции с неметаллами:
H2 + Cl2 –hn® 2HCl
2P + 3Cl2® 2PClЗ
224. Реакция с водой:
Cl2 + H2O«HCl + HClO
225. Реакции со щелочами:
Cl2 + 2KOH –5°C® KCl + KClO + H2O
3Cl2 + 6KOH –40°C® 5KCl + KClOЗ + 3H2O
Cl2 + Ca(OH)2® CaOCl2(хлорная известь) + H2O
226. Вытесняет бром и йод из галогеноводородных кислот и их солей.
Cl2 + 2KI ® 2KCl + I2
Cl2 + 2HBr ® 2HCl + Br2
Хлористый водород
Получение
227. Синтетический способ (промышленный):
H2 + Cl2® 2HCl
228. Гидросульфатный способ (лабораторный):
NaCl(тв.)+ H2SO4(конц.)® NaHSO4 + HCl
Химические свойства
229. Раствор HCl в воде - соляная кислота - сильная кислота:
HCl«H+ + Cl-
230. Реагирует с металлами, стоящими в ряду напряжений до водорода:
2Al + 6HCl® 2AlCl3 + 3H2
231. с оксидами металлов:
MgO + 2HCl ® MgCl2 + H2O
232. с основаниями и аммиаком:
HCl + KOH®KCl + H2O
3HCl + Al(OH)3®AlCl3 + 3H2OHCl + NH3® NH4Cl
233. ссолями:
CaCO3 + 2HCl®CaCl2 + H2O + CO2
HCl + AgNO3®AgCl¯ + HNO3
234. 2Fe + 3Cl2® 2FeCl3
235. Mg + 2HCl ® MgCl2 + H2
236. CaO + 2HCl ® CaCl2 + H2O
237. Ba(OH)2 + 2HCl ® BaCl2 + 2H2O
238. Pb(NO3)2 + 2HCl ® PbCl2¯ + 2HNO3
Хлорноватистая кислота HClO
Получение
239. Cl2 + H2O « HCl + HClO
Химические свойства
240. Разлагается, выделяя атомарный кислород
HClO –на свету® HCl + O
241. Со щелочами дает соли – гипохлориты
HClO + KOH®KClO + H2O
242. 2HI + HClO ® I2¯ + HCl + H2O
Хлористая кислота HCl+3O2
Получение
243. 2KClO3 + H2C2O4 + H2SO4® K2SO4 + 2CO2 + 2СlO2 + 2H2O
244. 2ClO2 + H2O2® 2HClO2 + O2
Химические свойства
245. HClO2 + KOH ® KClO2 + H2O
246. Неустойчива, при хранении разлагается
4HClO2®HCl + HClO3 + 2ClO2 + H2O
Хлорноватая кислота HClO3
Получение
247. Ba (ClO3)2 + H2SO4® 2HClO3 + BaSO4¯
Химические свойства
248. 6P + 5HClO3® 3P2O5 + 5HCl
249. HClO3 + KOH ® KClO3 + H2O
250. 3Cl2 + 6KOH ® 5KCl + KClO3 (Бертоллетова соль) + 3H2O
251. 4KClO3 –без кат® KCl + 3KClO4
2KClO3 –MnO2 кат® 2KCl + 3O2
Хлорная кислота HClO4
Получение
252. KClO4 + H2SO4® KHSO4 + HClO4
Химические свойства
253. HClO4 + KOH ® KClO4 + H2O
254. При нагревании хлорная кислота и ее соли разлагаются:
4HClO4 –t°® 4ClO2 + 3O2 + 2H2O
KClO4 –t°®KCl + 2O2
БРОМ И ЕГО СОЕДИНЕНИЯ
Получение
255. Окисление ионов Br - сильными окислителями:
MnO2 + 4HBr®MnBr2 + Br2 + 2H2O
Cl2 + 2KBr® 2KCl + Br2
Химические свойства
256. Реагирует с металлами:
2Al + 3Br2® 2AlBr3
257. Реагирует с неметаллами:
H2 + Br2« 2HBr
2P + 5Br2® 2PBr5
258. Реагирует с водой и щелочами :
Br2 + H2O«HBr + HbrO
Br2 + 2KOH®KBr + KBrO + H2O
259. Реагирует с сильными восстановителями:
Br2 + 2HI®I2 + 2HBr
Br2 + H2S®S + 2HBr
Бромистый водород HBr
Получение
260. 2NaBr + H3PO4 –t°® Na2HPO4 + 2HBr
261. PBr3 + 3H2O ® H3PO3 + 3HBr
Химические свойства
262. Диссоциация:
HBr « H+ + Br -
263. С металлами, стоящими в ряду напряжения до водорода:Mg + 2HBr®MgBr2 + H2
264. с оксидами металлов:
CaO + 2HBr®CaBr2 + H2O
265. с основаниями и аммиаком:
NaOH + HBr®NaBr + H2O
Fe(OH)3 + 3HBr®FeBr3 + 3H2O
NH3 + HBr ® NH4Br
266. с солями:
MgCO3 + 2HBr®MgBr2 + H2O + CO2
AgNO3 + HBr®AgBr¯ + HNO3
267. HBr - сильный восстановитель:
2HBr + H2SO4(конц.)® Br2 + SO2 + 2H2O
2HBr + Cl2® 2HCl + Br2
ИОД И ЕГО СОЕДИНЕНИЯ
Получение
268. Окисление ионов I- сильными окислителями:
Cl2 + 2KI® 2KCl + I2
2KI + MnO2 + 2H2SO4®I2 + K2SO4 + MnSO4 + 2H2O
Химические свойства
269. c металлами:
2Al + 3I2® 2AlI3
270. H2 + I2« 2HI
271. с сильными восстановителями:
I2 + SO2 + 2H2O ® H2SO4 + 2HI
I2 + H2S ® S + 2HI
272. 3I2 + 6NaOH ® 5NaI + NaIO3 + 3H2O
Иодистый водород
Получение
273. I2 + H2S ® S + 2HI
274. 2P + 3I2 + 6H2O ® 2H3PO3 + 6HI
Химические свойства
275. Раствор HI в воде - сильная йодистоводородная кислота:
HI«H+ + I-
2HI + Ba(OH)2®BaI2 + 2H2O
276. HI - очень сильный восстановитель:
2HI + Cl2® 2HCl + I2
8HI + H2SO4(конц.)® 4I2 + H2S + 4H2O
5HI + 6KMnO4 + 9H2SO4® 5HIO3 + 6MnSO4 + 3K2SO4 + 9H2O
277. Идентификация анионов I- в растворе:
NaI + AgNO3® AgI¯ + NaNO3
HI + AgNO3® AgI¯ + HNO3
278.
| HCl | соляная | хлориды |
| HNO3 | азотная | нитраты |
| H2SO4 | серная | сульфаты |
| H3PO4 | ортофосфорная | ортофосфаты |
| H2CO3 | угольная | карбонаты |
| H2S | сероводордная | сульфиды |
| H2SO3 | сернистая | сульфиты |
| HBr | бромоводородная | бромиды |
| H2SiO3 | кремниевая | силикаты |
Cвойства кислот:
1) + металл®соль + H2
2) + осн оксид®соль + H2O
3) + основание®соль + H2O
4) С кислотами не реагируют: Cu, Hg, Ag, Au, Pt.
Cвойства щелочей:
1. + кислота ® соль+ H2O
реакция нейтрализация
2. +кисл оксид ® соль+H2O
3. + соль ® нераств основание + новая соль
Химические свойства воды:
1) + активный металл ® щелочь + H2
(LiNaKCaBaMg)
2) + металл ср активности ® оксид Me + H2
3) + оксид Me® щелочь
(осн оксид)
4) + оксид не металла ® кислота
Химические свойства оксидов |
| Основных | Кислотных |
| 1. Основные оксиды взаимодействуют с кислотами, получаются соль и вода:
CuO + H2SO4 = CuSO4 + H2O 2. 2. Оксиды активных металлов взаимодействуют с водой с образованием щелочи:
Li2O +H2O=2LiOH | 1.Кислотные оксиды взаимодействуют с растворимыми основаниями, получаются соль и вода:
СO2 + Ca (OH)= CaCO3 + H2O 2.Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты:
P2O5 + 3 H2O = H3PO4 |
| 3. Основные и кислотные оксиды взаимодействуют между собой с образованием соли:
CaO + CO2 = CaCO3 |
| | 4. Менее летучие кислотные оксиды вытесняют более летучие из их солей:
СaCO3 + SiO3 = CaSiO3 + CO2 |
| | |